什么是原研药?什么是仿制药?
原研药主要指首家研发上市的药品,原研药已过了专利保护期的,其它企业可以进行仿制;仿制药是与原研药具有相同的活性成分、剂型、给药途径和治疗作用的药品。
什么是“药品一致性评价”呢?
仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,分期分批进行质量一致性评价,就是仿制药需在质量与药效上达到与原研药一致的水平。开展仿制药一致性评价,可以使仿制药在质量和疗效上与原研药一致 ,在临床上可替代原研药,这不仅可以节约医疗费用,同时也可提升我国的仿制药质量和制药行业的整体发展水平,保证公众用药安全有效。
药物一致性评价中的“一致”主要分为两个方面:
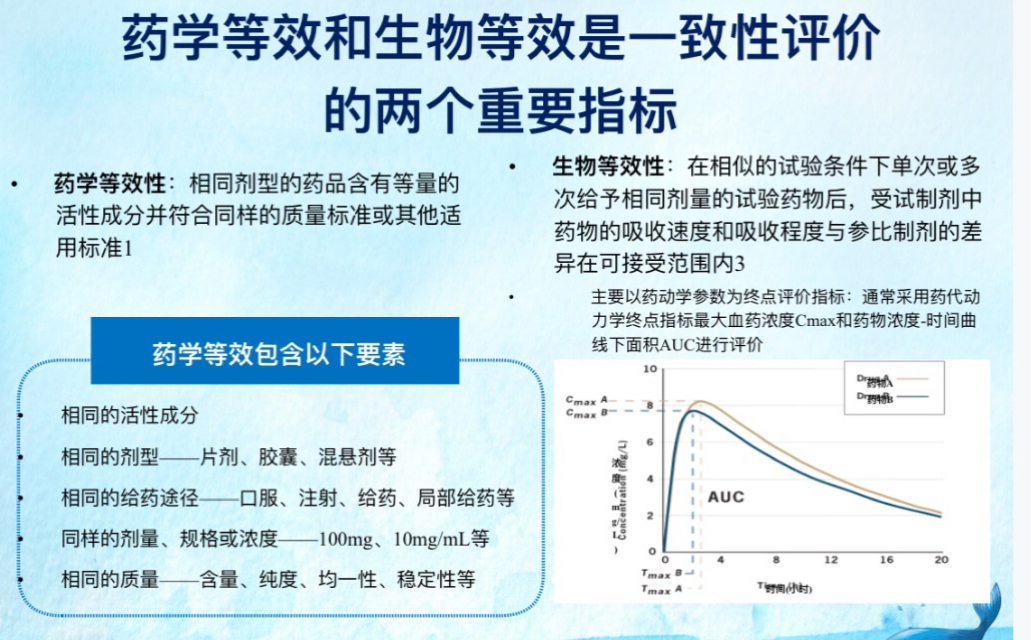
一、药学等效性
仿制药必须与原研药(参比制剂)具有一样的药物活性成分、剂量、给药途径、剂型,并且必须符合药品质量标准(活性成分含量,药品纯度,均匀度,崩解时间,溶出速率等)
在非活性成分方面(即不治病的部分,比如帮助药片成型而添加的淀粉、蔗糖等物质),仿制药不需要做到与原研药完全一致。
二、生物等效性
生物等效性的验证即指医药界经常提到的BE实验,其标准要求仿制药制剂在体内的吸收、代谢情况必须与原研药一致。(例如,药物在体内被吸收的药量及扩散速度,血药浓度峰值等数据。)简单来说,就是会有一组健康人作为受试者吃下研发好的仿制药,然后定期取血来检测其血药浓度(血液中含药物的多少)等指标。相隔一段时间后(取决于药品的半衰期),同组受试者再服用原研药,同样取血来检测其血药浓度。
最终,将所得的两组数据制成折线图,进行比较,当检验中要求评测的所有数据全部通过一致性的标准后,该仿制药产品才有资格通过生物等效性的验证。
两个等效性(药学+生物学)均满足后药品才有资格申请 “一致性评价” 的批准。
当然,除了上述两个等效性的检验外,还有林林总总的各种从研发到生产的要求及药监局的现场检查。
例如:相同的适应症
仿制药与已批准的原研药需具有相同的说明书和标签,相同的使用条件和适应症(治疗的病症)。
相同的质量控制和管理
仿制药的生产与原研药一样,须符合药品生产质量规范,简称符合GMP要求。
通过一致性评价的仿制药是与原研药质量和疗效一致的药品,在临床上可以实现与原研药的相互替代。仿制药品的包装盒上多了一个下图的图案。

 闽公网安备35010202000953号
闽ICP备16035253号
闽公网安备35010202000953号
闽ICP备16035253号





