各相关企业:
《福建省药品阳光采购非竞争组药品年审制度》已经省医保局同意,现印发给你们,请认真遵照执行。
福建省药械联合采购中心
2021年4月28日
福建省药品阳光采购非竞争组药品年审制度
为确保我省药品阳光采购政策准确执行,根据《福建省医疗保障管理委员会办公室关于开展以医保支付结算价为基础的药品联合限价阳光采购工作的通知》(闽医保办〔2017〕16号)及国家药品监管部门等公布的相关文件信息,省药械联合采购中心(以下简称采购中心)制定药品阳光采购部分类别非竞争组药品年审制度。
(一)年审范围
2.申报境外制药公司全球首家研发上市,原料进口至境内,授权专利由非隶属关系境内制药企业生产的原研药品。
3.通过FDA认证药品。
4.其他需纳入年审范围的药品。
(二)年审时间
采购中心于每年度第三季度开展集中审核工作,具体开展时间另行公告。
(三)填报要求
1.登陆福建省药械联合限价阳光采购平台,进入产品基础资料填报模块,根据下表要求在原研属性(需对应类别)、FDA属性项目下补充更新相关材料,点击“确认提交年审材料”,并“保存”上传(材料无需补充更新的,也需进行上述提交与保存操作)。
|
序号
|
类别
|
要求提交材料
|
|
1
|
原研药品
|
境外制药公司全球首家研发上市,由境内有隶属关系(独资或控股合资)制药企业进行生产的药品。
|
需提交以下1或2所列有效材料之一:
1.①专利:必须拥有活性成分专利,包括化合物专利、天然药物提取物专利、微生物及其代谢物专利、至少某一有效成分为化合物专利的组合物专利
②药品生产批件
③隶属关系证明材料
2.参比制剂目录内备注为原研地产化等类型药品截图
|
|
2
|
境外制药公司全球首家研发上市,原料进口至境内,授权专利由非隶属关系境内制药企业生产的药品。
|
需提交以下1或2所列有效材料之一:
①专利:必须拥有活性成分专利,包括化合物专利、天然药物提取物专利、微生物及其代谢物专利、至少某一有效成分为化合物专利的组合物专利
②合约期内授权书(含授权、质量控制体系)
③原料进口批件
④使用原研企业原料药的最新批次佐证材料(原则上需提供近2年报关单及采购发票等)
2. 参比制剂目录内备注为原研地产化等类型药品截图
|
|
3
|
通过FDA认证药品
|
申报药品在FDA官网的NDA或ANDA数据库注册且处于有效状态。
|
1.FDA官网的NDA或ANDA数据库注册截图,且状态不处于“Discontinued”等间断或终止状态。
2.出口欧美最新批次报关单及中文翻译(原则上需提供近2年内)
3.共线生产且质量相同承诺函
|
2.填报资料涉及与其他关联企业信息时,需对其中的关联情况予以说明;对相关协议、授权等证明材料未明确有效日期或已过有效日期的,需提交仍在有效期内的证明材料。
3.属参比制剂目录内药品,可在产品基础资料填报模块选择“参比制剂”类型。
4.在日常履约周期内,各相关企业对出现影响药品竞价分组动态变化的情况,须及时主动填报或更新药品申报资质相关信息。
5.企业应如实提供和填报信息材料,对弄虚作假、歪曲事实、恶意投诉的,一经查实,将根据《福建省医疗保障局关于建立医药价格和招采信用评价制度的通知》(闽医保〔2021〕1号)、《福建省医疗保障管理委员会办公室关于印发福建省药品联合限价阳光采购药品供应履约管理办法的通知》(闽医保办〔2017〕72号)、《福建省药械阳光采购承诺书》等我省药品采购有关规定处理。
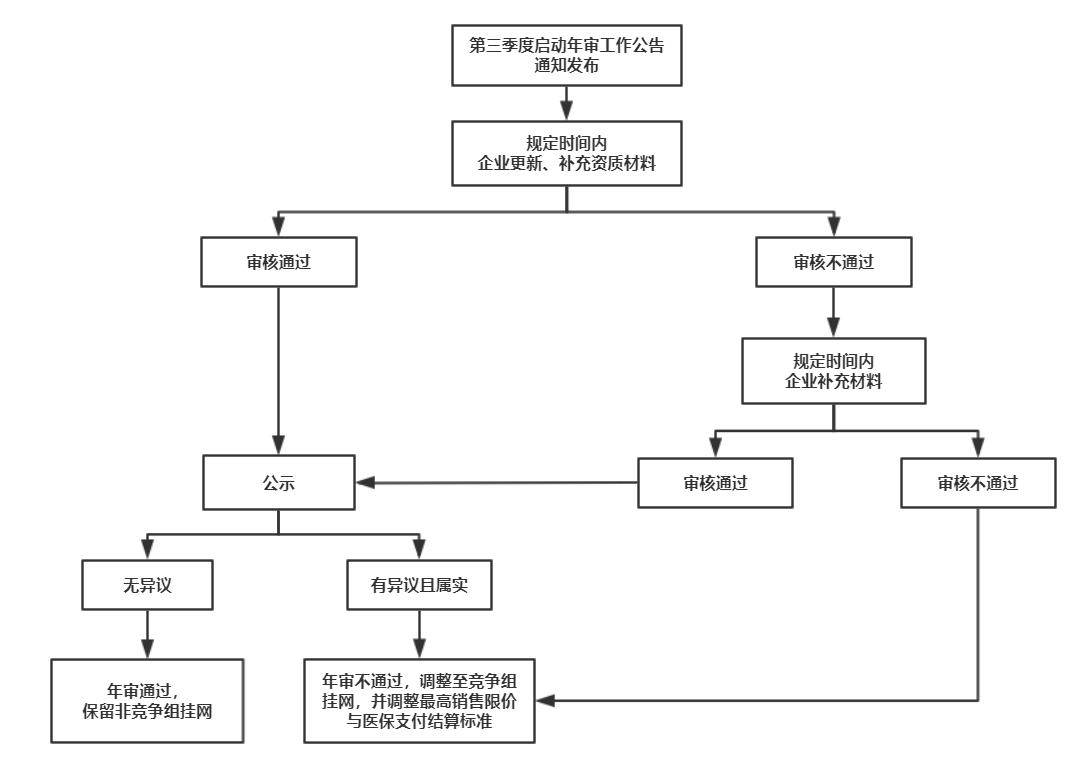
(四)年审结果
1.审核通过且经公示无异议的药品,确定保留非竞争组挂网。
2.审核通过但经公示有异议,经核查反映情况属实的药品,予以调整竞价分组至竞争组,并按竞争组规则调整最高销售限价及医保支付结算标准。
3.审核不通过的药品,企业须在规定时间内按要求提交补充材料,未予以补充或补充后再次审核不通过的,予以调整竞价分组至竞争组,并按竞争组规则调整最高销售限价及医保支付结算标准。
(五)年审流程
年审相应流程原则上按下图流程执行:
 闽公网安备35010202000953号
闽ICP备16035253号
闽公网安备35010202000953号
闽ICP备16035253号




